Des chercheurs réussissent à corriger un gène défectueux dans des embryons
Des chercheurs réussissent à corriger un gène défectueux dans des embryons
Par Paul Benkimoun
En utilisant l’outil Crispr-Cas9, qui permet de modifier le génome, une équipe internationale a effacé une mutation génétique responsable d’une maladie cardiaque.
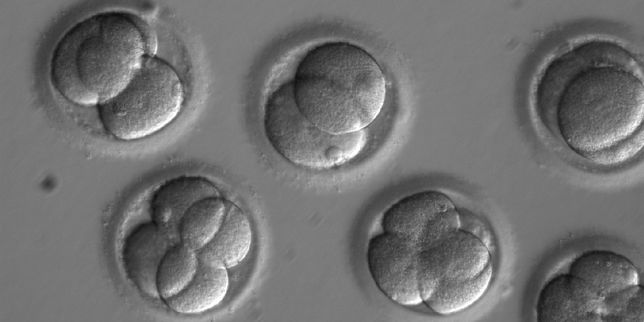
Quelques-uns des embryons ayant servi dans l’expérience, deux jours après la fécondation in vitro. | OHSU.
Les « ciseaux génétiques » Crispr-Cas9, qui permettent de faire du couper-coller dans le génome, ont encore frappé. Ainsi que l’annonce une étude publiée mercredi 2 août par la revue Nature, une équipe internationale de chercheurs a, grâce à cette technique, réussi à effacer chez des embryons humains une mutation à l’origine d’une grave maladie cardiaque. Compte tenu de la réglementation, les embryons n’étaient pas destinés à être implantés et leur développement a été interrompu après quelques jours. Cette démonstration expérimentale appuie l’idée que cette méthode pourrait être appliquée à d’autres maladies génétiques, si les interrogations sur sa sécurité et les obstacles éthiques sont dissipés. Cela impliquera des essais cliniques qui restent, selon les auteurs, « une perspective encore éloignée ».
Quelque dix mille maladies génétiques graves impliquent la mutation d’un seul gène. Parmi elles, certaines sont dites « dominantes » car il suffit que l’un ou l’autre des parents possède et transmette le gène muté pour que l’enfant soit atteint. Le risque est donc de 50 %. A l’heure actuelle, la seule riposte possible de la médecine dans un tel cas est le recours au diagnostic préimplantatoire, qui requiert le passage par une fécondation in vitro. Les embryons obtenus sont ensuite triés afin de n’implanter que ceux qui sont porteurs de deux versions normales du gène. Cette procédure suppose plusieurs cycles de stimulation ovarienne avant le prélèvement d’ovocytes à féconder.
« Notre but est de guérir des maladies graves, explique Paulo Amato, l’une des principaux auteurs de cette étude avec Shoukhrat Mitalipov (tous deux à l’Oregon Health and Science University, Portland). Nous avons choisi de nous pencher sur le cas d’un gène appelé MYBPC3, dont la mutation entraîne une cardiomyopathie hypertrophique. » Cette maladie du muscle cardiaque, qui touche une personne sur cinq cents, provoque principalement un épaississement de la paroi du ventricule gauche et, dans les formes les plus graves, des troubles du rythme cardiaque et des morts subites.
Pour cette étude, qui a reçu les autorisations des comités d’éthique des universités concernées, l’équipe américano-sino-coréenne a recruté un homme porteur de la mutation du gène MYBPC3 — avec une version normale et une version mutée — et plusieurs donneuses d’ovocytes non porteuses de la mutation. Dix-neuf ovocytes ont été fécondés de manière classique avec le sperme du donneur, sans qu’on y touche après, afin de servir de comparateurs. Pour les cinquante-huit autres, les chercheurs ont ensuite eu recours à l’outil d’édition génétique Crispr-Cas9, qui permet la réparation ciblée de l’ADN. Les embryons ont été cultivés durant trois jours. Passé ce délai, les cellules encore indifférenciées des embryons (blastomères) ont été isolées pour être séquencées.
Comme on pouvait s’y attendre, les embryons servant de contrôles se partageaient entre porteurs de la mutation et ceux qui en étaient exempts. Un fifty-fifty que l’on ne retrouvait pas chez les embryons auxquels la procédure Crispr-Cas9 avait été appliquée. Deux tiers d’entre eux portaient deux versions normales du gène, le tiers restant étant soit hétérozygote (un gène normal et un muté), soit une mosaïque (coexistence de cellules normales et de cellules hétérozygotes). De manière prédominante, le recours aux ciseaux génétiques a entraîné une réparation homologue, mais l’existence de ces mosaïques pose un problème : un diagnostic préimplantatoire pour contrôler la bonne réussite de l’opération pourrait en effet passer à côté de cellules porteuses de la mutation.
Les limitations éthiques
Pour cette première expérience, l’injection de Crispr-Cas9 avait lieu lors de la phase S de la division cellulaire, celle où l’ADN est entièrement répliqué, ce qui pourrait avoir pour conséquence que certains spermatozoïdes soient porteurs de la mutation et d’autres non. Les chercheurs ont donc changé leur approche en injectant Crispr-Cas9 en même temps que le spermatozoïde lorsque l’ovocyte était dans une phase postérieure, « ce qui permet à l’édition du génome de se produire lorsque le spermatozoïde contient à coup sûr une seule copie mutante du gène », expliquent-ils.
Avec cette modification, le taux de cellules embryonnaires exemptes de la mutation a atteint 72 % et il n’y avait plus de mosaïques. De plus, l’équipe n’a décelé aucun effet « hors cible », c’est-à-dire de modification génétique non souhaitée. Le moment où le procédé est utilisé semble donc déterminant pour son efficacité.
Les auteurs de l’étude en concluent que « la correction génétique récupérerait des embryons mutants, augmenterait le nombre d’embryons disponibles pour une implantation et, au bout du compte, améliorerait le taux de grossesse ». L’un des auteurs, Sanjiv Kaul (lui aussi de l’Oregon Health and Science University), estime que la méthode est susceptible d’être appliquée à beaucoup d’autres mutations génétiques, notamment à celles affectant les gènes BRCA1 et BRCA2, qui prédisposent aux cancers du sein et de l’ovaire. Toutefois, Shoukhrat Mitalipov juge qu’il « y a encore une marge de progression dans l’efficacité avant de passer à un essai clinique. »
Ces travaux soulèvent des questions. Il faut tout d’abord améliorer la technique et s’assurer qu’elle évite la formation de mosaïques et du hors-cible, avant d’en venir à des implantations d’embryons. Sur le plan éthique ensuite, la convention d’Oviedo, ratifiée en 2011 par la France, autorise les interventions sur le génome humain uniquement à des fins préventives, diagnostiques et thérapeutiques, mais seulement si elles n’entraînent pas de modification dans le génome de la descendance. Cela exclurait donc le procédé employé dans cette étude.
La poursuite de ces travaux, déjà limités aux Etats-Unis par l’interdiction d’employer des fonds publics pour la recherche sur l’embryon, ne pourrait donc se faire que dans des pays aux législations plus souples, comme le Royaume-Uni. Le débat sur les frontières éthiques où doivent s’arrêter les perspectives de progrès médical ne fait que commencer.