L’anti-épileptique Dépakine à l’origine d’au moins 450 malformations à la naissance
L’anti-épileptique Dépakine à l’origine d’au moins 450 malformations à la naissance
LE MONDE ECONOMIE
Les patientes enceintes ont été informées trop tard des risques liés au médicament.
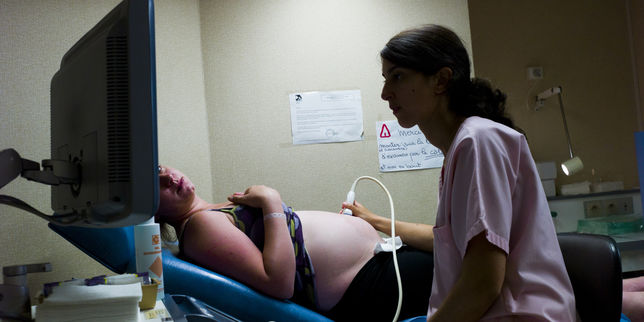
Au cours des derniers mois, les autorités de santé ont multiplié les mises en garde sur ce médicament responsable chez le fœtus de malformations et de troubles tels que l’autisme. | FRED DUFOUR / AFP
Les patientes traitées avec de la Dépakine ont été informées trop tard des risques liés à la consommation de ce médicament pendant la grossesse. C’est la conclusion d’une enquête de l’Inspection générale des affaires sociales (IGAS) publiée, mardi 23 février, sur le valproate de sodium, une molécule prescrite par les médecins pour prévenir les crises d’épilepsie et les troubles bipolaires. Elle critique le « manque de réactivité » des autorités sanitaires et du laboratoire Sanofi, qui ont longtemps minimisé les effets d’une exposition in utero.
Le risque de malformations congénitales a commencé à filtrer à partir des années 1980, et l’impact négatif sur le développement cognitif est connu depuis la fin des années 2000. Mais les notices destinées à informer les patients ne les mentionnent explicitement que depuis 2006 pour le premier, et 2013 pour le second. « On partait du principe qu’il valait mieux ne pas trop en dire au patient, qu’il revenait au médecin de l’informer. Cela a changé », dit Dominique Martin, directeur général de l’Agence nationale de sécurité du médicament.
93 000 femmes traitées
Sanofi rappelle avoir proposé dès 2003 une modification des documents mais les autorités ne l’ont pas validée. « Nous avons proposé des évolutions en nous appuyant sur les données de pharmacovigilance et sur la littérature scientifique », dit le docteur Pascal Michon, directeur médical de Sanofi France.
Depuis avril 2015, ce médicament ne doit en principe plus être prescrit aux femmes en âge d’avoir des enfants, sauf s’il n’existe pas d’alternative. Dans ce cas, les patientes doivent signer un formulaire de consentement, et le présenter au pharmacien avec l’ordonnance. Chez les personnes épileptiques, « tout changement de traitement présente un risque », insiste Vincent Navarro, neurologue à la Pitié-Salpêtrière. « Lors des crises, les patients peuvent se blesser gravement, voire mourir soudainement », précise le médecin.
La Dépakine est commercialisée en France par Sanofi depuis 1967, et sous forme générique par d’autres entreprises. En psychiatrie, le valproate de sodium est vendu par le laboratoire français sous les marques Depakote et Depamide. Selon l’Inspection les prescriptions de valproate de sodium aux femmes en âge d’avoir des enfants (15-49 ans) ont baissé de 25 % entre 2006 et 2014. Leur nombre est passé de 125 000 à 93 000, dont 56 000 pour des troubles bipolaires et 37 000 pour de l’épilepsie.
En extrapolant des données obtenues dans la région Rhône-Alpes à la France entière, l’IGAS estime qu’entre 425 et 450 bébés exposés in utero au valproate de sodium sont nés avec une malformation entre 2006 et 2014. Il faudra cependant attendre le mois de mai pour avoir une « mesure plus précise de l’impact des prescriptions de valproate sur la descendance des femmes exposées », précise l’IGAS.
Fin septembre, le parquet de Paris a ouvert une enquête sur les conditions d’autorisation et de commercialisation des anti-épileptiques Dépakine. Selon Le Figaro, le ministère de la santé envisagerait la mise en place d’un fonds d’indemnisation pour les victimes, comme pour le Mediator.